1808
Modelo de Dalton

O primeiro modelo reconhecido cientificamente para explicar a constituição da matéria foi proposto no início do século XIX pelo cientista inglês John Dalton. Segundo ele, a matéria é constituída de partículas denominadas átomos, os quais seriam pequenas esferas maciças, indivisíveis e indestrutíveis. Por conta dessa descrição, em muitas referências, é mencionado como modelo da “bola de bilhar”.
Os átomos de mesmo tamanho e massa corresponderiam ao mesmo elemento químico. Assim, elementos químicos distintos teriam massa e tamanho diferentes. Como não podem ser criados, divididos ou destruídos, os átomos dos elementos químicos presentes nas substâncias iniciais se rearranjam em uma reação química, formando novas substâncias.
Apesar de ser o primeiro modelo atômico científico, o modelo de Dalton era semelhante ao proposto pelos filósofos gregos Demócrito e Leucipo.
1898
Modelo de Thomson
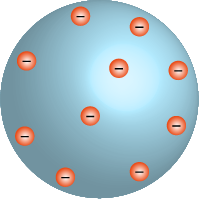
No fim do século XIX, os estudos sobre a estrutura do átomo começaram a ganhar mais força, apresentando as primeiras noções sobre a natureza elétrica da matéria.
Com os avanços nas investigações científicas, comprovou-se que o átomo poderia ser dividido, ou seja, que seria formado por partículas ainda menores. Em 1897, o físico britânico Joseph Thomson realizou experimentos que comprovaram a existência do elétron como partícula subatômica. Esse cientista considerava que, como a matéria tem carga neutra, o átomo deveria ser uma esfera de carga positiva onde os elétrons, de carga negativa, estariam fixados e, assim, as cargas estariam equilibradas. Por conta dessa descrição, é possível encontrar, em algumas referências, a menção a esse modelo como “pudim de passas” (na Inglaterra, tipo de bolo com passas incrustradas).
1911
Modelo de Rutherford
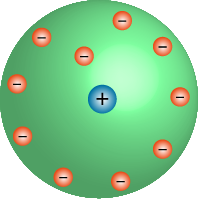
Apesar de a descoberta do elétron ter representado um grande avanço para os cientistas compreenderem a estrutura do átomo, ainda não era suficiente para explicar outros fenômenos observados.
Ainda no fim do século XIX, o físico neozelandês Ernest Rutherford, com base em seus estudos sobre radioatividade, conseguiu comprovar que o átomo poderia ser dividido derrubando de vez o modelo de Dalton. E diferentemente do modelo de Thomson, para Rutherford haveria uma parte central, pequena e maciça, na qual se concentrava toda a carga positiva e, praticamente, toda a massa do átomo – região chamada de núcleo. Enquanto, os elétrons estariam ao redor desse núcleo em um grande espaço vazio denominado eletrosfera. Em algumas referências, esse modelo é mencionado como “sistema solar”.
1913
Modelo de Rutherford-Bohr
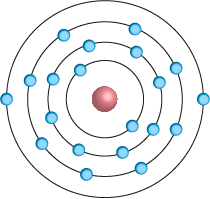
No início do século XX, o físico dinamarquês Niels Bohr realizou experimentos para explicar as emissões de luz (e suas cores) por diferentes gases, em condições específicas. Bohr, então, constatou que os elétrons não estavam totalmente livres no espaço vazio e, assim, propôs que a eletrosfera estava organizada em camadas, na qual o elétron girava em órbita circular ao redor do núcleo. De acordo com alguns dos seus postulados, um átomo teria um número limitado de camadas que acomodariam uma quantidade específica de energia.
1932
Modelo atômico básico
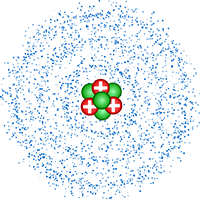
Por volta de 1932, o físico britânico James Chadwick propôs que no núcleo, junto aos prótons, haveria também partículas subatômicas sem carga elétrica – os nêutrons, responsáveis por equilibrar a carga no núcleo do átomo. Após essa descoberta, o modelo atômico de Rutherford-Bohr foi submetido a muitos outros aprimoramentos com contribuições de diversos cientistas. Entre eles, destacam-se o físico austríaco Erwin Schrödinger e o físico alemão Werner Heisenberg, que por meio de estudos com equações matemáticas conseguiram demonstrar que o núcleo atômico, formado por prótons e nêutrons, está envolvido por um tipo de nuvem eletrônica em que os elétrons estão em constante movimento. Os cálculos não puderam definir a posição exata dos elétrons, mas foram capazes de determinar a região do espaço onde a probabilidade de encontrar o elétron é máxima.
Até os dias atuais, os cientistas ainda não esclareceram por completo a estrutura do átomo. Com o auxílio dos aceleradores de partículas, hoje, sabe-se que os prótons e os nêutrons não são partículas elementares, pois se dividem e formam outras partículas, como os quarks, léptons, hádrons, mésons, neutrinos, entre outros. Porém, considera-se que o elétron, o próton e o nêutron são as partículas básicas da estrutura do átomo. Por isso, apesar de existirem outros modelos atômicos mais modernos comprovados por cálculos mais avançados, o modelo atômico básico é considerado suficiente para explicar a estrutura da matéria e o comportamento do átomo.